MICROCOSME combine des approches computationnelles et expérimentales pour analyser, ingénierer et contrôler la croissance des micro-organismes. L’équipe rassemble des chercheurs de l’Inria Grenoble – Rhône-Alpes et du Laboratoire Interdisciplinaire de Physique à l’Université Grenoble Alpes (CNRS UMR 5588).
La croissance microbienne
On trouve des micro-organismes partout, dans le sol, l’eau et chez l’humain où on compte environ 1,3 cellule bactérienne pour chaque cellule humaine. La principale caractéristique des micro-organismes est leur capacité à grandir et se multiplier, c’est-à-dire à transformer les nutriments de leur environnement en nouvelles cellules microbiennes. Ces dernières se multiplient rapidement en conditions permissives (un doublement toutes les 20 minutes), lentement dans des conditions adverses (un doublement toutes les quelques heures ou jours), voire pas du tout en cas de stress extrême. Comprendre et contrôler la dynamique de la croissance bactérienne est primordiale en santé, médecine, biotechnologie et dans l’industrie alimentaire, par exemple, pour stopper la croissance de pathogènes ou stimuler la croissance de probiotiques ou de micro-organismes industriels.
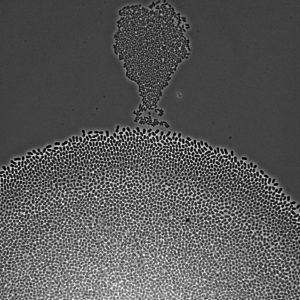
Image en microscopie de bactéries Escherichia coli poussant sur un milieu nutritif solide. Certaines bactéries ont poussé sous la forme d’une montgolfière (haut de la photo) et, en colonisant la surface, vont bientôt fusionner avec une autre colonie plus grande (bas). Ces bactéries ont la forme de bâtonnets de 2 µm de long et se divisent toutes les 20 minutes dans les conditions expérimentales dans lesquelles la photo a été prise. Crédit : Antrea Pavlou, Décembre 2020.
Les dessous de la croissance
La croissance microbienne est un phénomène multi-échelle, dans le sens où l’observable macroscopique, la croissance d’une population microbienne, dépend de nombreuses voies métaboliques et de mécanismes de régulation qui opèrent au niveau microscopique à l’intérieur des cellules. Les nouvelles approches expérimentales ont permis de décrire de façon quantitative et détaillée ces voies métaboliques et ces mécanismes de régulations, incluant des mécanismes de rétroaction complexes opérant sur différentes échelles de temps. Les avancées récentes dans l’ingénierie des génomes utilisent cette connaissance pour permettre des modifications génétiques dirigées qui transforment les micro-organismes en usines microbiennes capables de produire une diversité de métabolites, peptides et protéines d’intérêt industriel ou médical.
Malgré ces avancées technologiques, de nombreuses questions fondamentales sur la croissance microbienne restent ouvertes. Par exemple, celle-ci nécessite la synthèse de composants cellulaires en temps et en heure tout en répondant à des contraintes de resources. Comment les cellules coordonnent-elles les différents processus intracellulaires de croissance et ajustent le taux de croissance bactérienne à un environnement changeant ? Comment allouent-elles leur machineries cellulaires en nombre limité à ces processus cellulaires afin de pousser de façon optimale dans des conditions permissives ou de survivre dans des environnements stressants ? Comment des fluctuations conduisent à une hétérogénéité de croissance au sein d’une population ? Comment stabiliser par un contrôle en feedback la composition d’une communauté microbienne synthétique et ainsi optimiser la production d’un métabolite d’intérêt ?
La recherche au sein de MICROCOSME
La recherche menée dans MICROCOSME vise à répondre aux questions décrites ci-dessus. Le programme de l’équipe est organisé autour de quatre axes représentés schématiquement ci-dessous. Ils ont recours à des outils de la modélisation mathématique (stochastique et déterministe), l’analyse des systèmes dynamiques, la théorie du contrôle, l’ingénierie du génome et des bioprocédés :
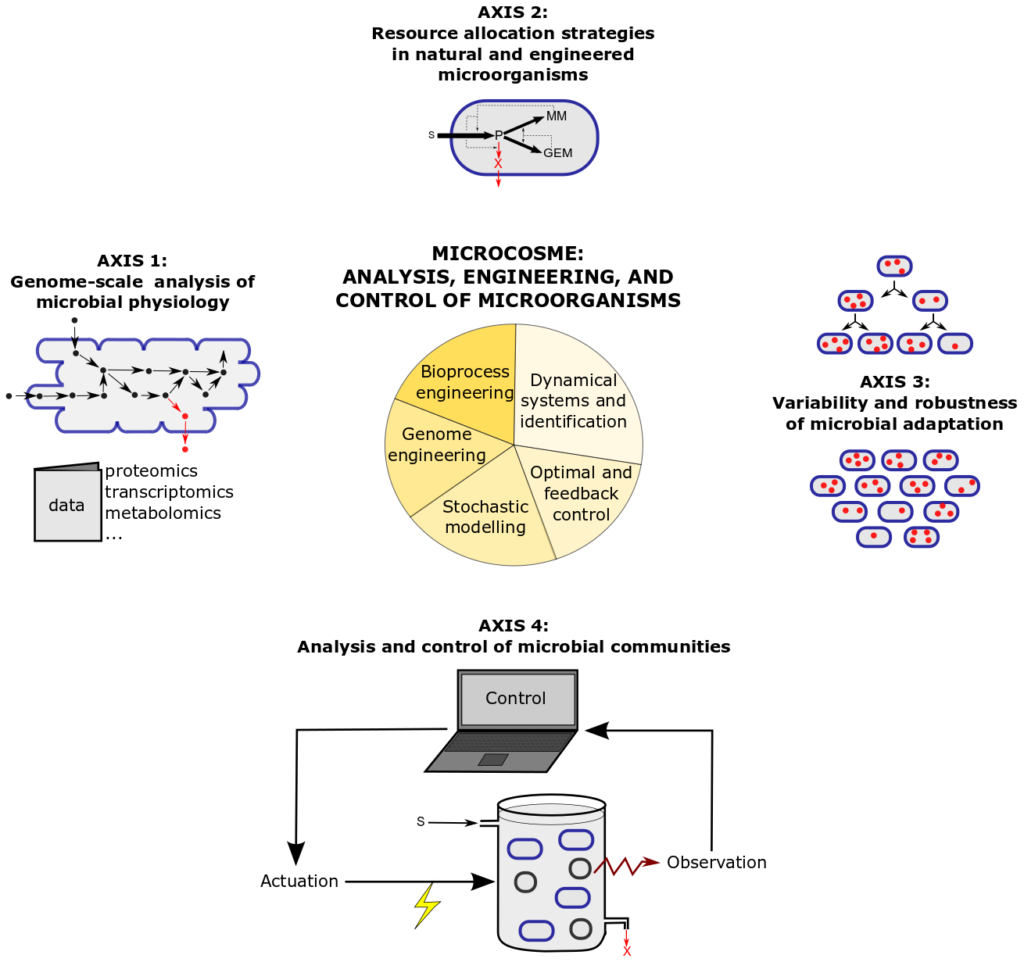
Axes de recherche et méthodes dans MICROCOSME. Le premier axe est dédié à la compréhension de la physiologie cellulaire à l’échelle du génome par l’analyse de données à haut-débit par des modèles. Ceci nous permet de comprendre comment les cellules ajustent les processus impliqués dans la croissance cellulaire aux conditions environnementales. Cette coordination est le reflet de stratégies évoluées par les micro-organismes pour allouer leurs resources à différentes fonctions cellulaires pour croître optimalement. L’analyse de ces stratégies naturelles et leur ré-ingénierie est l’objet du second axe de recherche. Celui-ci voit les cellules comme des auto-réplicateurs qui peuvent être décrits par des modèles gros grain et analysés par des approches de théorie du contrôle. Dans l’axe 2, nous adoptons un angle différent pour analyser la variabilité et la robustesse de la croissance microbienne. En particulier, nous employons des modèles stochastiques qui utilisent des données de cellules uniques dans une population plutôt que des données moyennées sur la population. Dans l’axe 4, une variabilité d’un genre différent est étudiée, l’hétérogénéité au sein de communautés constituées de différentes espèces microbiennes et comment cette communauté peut être conrôlée pour des applications biotechnologiques. La recherche réalisée dans ces quatre axes reposent sur les approches méthologiques décrites au sein de la figure.

